PM-1451-17 - Sistema para Osteosíntesis - Peek
Antes de usar este producto lea atentamente la siguiente información.
Importante
Micromed System S.A. garantiza la calidad de sus productos.
Este folleto está diseñado con el fin de asistirle en el empleo de este producto. Los productos médicos fueron diseñados, comprobados y fabricados para ser utilizados en un solo paciente. Micromed System S.A. no se responsabiliza del inadecuado uso o reutilización del producto, debido a que ello puede conducir a lesión en el paciente. También queda prohibido su reprocesamiento y/o reesterilización. El reprocesamiento y/o reesterilización de estos productos médicos podría crear un riesgo de contaminación e infección del paciente. No reutilizar, reprocesar o reesterilizar estos implantes.
INDICACIONES, CONTRAINDICACIONES, EFECTOS SECUNDARIOS NO DESEADOS
Generalidades:
Al principio de fijación se aplican principios generales de selección del paciente y un sano juicio quirúrgico. La selección correcta del implante es extremadamente importante. La posibilidad de éxito o fracaso aumentan o disminuyen con la elección apropiada del tamaño y diseño del implante a utilizar. El cirujano debe estar familiarizado con la técnica de colocación y las características de los materiales empleados. El tamaño y forma de huesos humanos presenta restricciones que limitan el tamaño y fuerza de los implantes. Ningún implante resiste la presión del peso corporal total. Por dicho motivo, para lograr la recuperación de la cirugía el paciente debe utilizar algún soporte externo adecuado y resistir las actividades físicas que puedan dar presión adicional sobre el implante o permitir cualquier movimiento en el área de fijación que pueda causar retardo del proceso de consolidación. Antes de someter el implante a una carga funcional, se debe asegurar el tiempo de consolidación de los tejidos óseos.
Indicaciones
El Sistema para Osteosíntesis PEEK de Micromed System S.A. está destinado a la unión de fragmentos óseos en el tratamiento de fracturas, pseudaoartrosis, consolidaciones fallidas o viciosas, osteotomías, artrodesis y patologías asociadas a las lesiones ya mencionadas.
Contraindicaciones
• Cualquier estado estructural o patológico del hueso o del tejido blando que se desea fijar que se considere que puede impedir una buena fijación al hueso.
• Otras condiciones físicas que eliminarían o tenderían a eliminar el soporte adecuado del implante o retrasarían la curación, por ejemplo, escasez en la circulación de la sangre, infecciones, etc.
• La incapacidad o falta de disposición del paciente para limitar sus actividades a los niveles prescriptos o seguir el programa de rehabilitación durante el periodo de curación.
• Sospecha de sensibilidad a cuerpos extraños o alergias.
• Si se sospecha que el paciente tiene alguna sensibilidad a cuerpos extraños, deben efectuarse las pruebas apropiadas antes de la elección del implante.
• Pacientes menores de 16 años o aquellos que no han alcanzado una madurez ósea.
Efectos secundarios no deseados
Siguiendo las advertencias no deberían producirse accidentes o efectos secundarios no deseados. Dentro de las complicaciones se incluyen:
- Sensibilidad, alergia u otras reacciones tisulares al material del dispositivo.
- Infección local o sistémica.
- No-consolidación o consolidación fallida.
- Perdida de fijación.
- Fracaso de la reconstrucción.
- Ruptura del dispositivo.
- Migración o movilización del dispositivo.
- Daños neurológicos en función del trauma quirúrgico.
Algunas de estas complicaciones pueden requerir intervención quirúrgica adicional.
El uso inadecuado del implante o el sometimiento a fuerzas mayores a las que requiere la técnica quirúrgica puede producir ruptura del implante por lo cual se debe tomar en cuenta retirar el material que pudiera quedar dentro del organismo como consecuencia de esta mala práctica.
Instrucciones de uso
Antes de utilizar este producto es preciso estar familiarizado con la técnica.
Los implantes de Sistemas para Osteosíntesis PEEK de Micromed System S.A. están diseñados para la unión de dos o más estructuras óseas según la técnica a emplearse.
Determinados los fragmentos a unir, y para el caso de colocación de tornillos y/o placas, se procede a la colocación del implante previo pasaje de mecha, macho y determinación de longitud de tornillo a emplear. Se recomienda respetar los principios AO para la colocación de osteosíntesis. Para el caso de clavos, luego de iniciar, se procede al fresado en caso de corresponder, y finalmente a la colocación del implante.
Advertencias y Precauciones
¡Advertencia!
Este producto médico debe ser manipulado únicamente por un profesional cirujano/traumatólogo entrenado en la/s técnica/s quirúrgica/s específica/s.
1. Antes de emplear los implantes del Sistema para Osteosíntesis PEEK de Micromed System S.A., los usuarios deben estar familiarizados con los procedimientos y técnicas quirúrgicas al respecto.
2. Deben controlarse las actividades postoperatorias a fin de asegurar el cumplimiento por el paciente del régimen de rehabilitación prescrito.
3. Conviene informar al paciente de la posibilidad de que deba ser retirado el implante si el mismo sufre problemas persistentes en relación con el producto médico.
4. Conviene informar al paciente de los cuidados postoperatorios.
5. Las complicaciones son las que se encuentran habitualmente en cualquier procedimiento de reconstrucción de las lesiones indicadas anteriormente.
6. En caso de que el producto se proporcione estéril, No debe volver a esterilizarse.
7. Para insertar correctamente el implante es necesario usar el sistema de introducción correspondiente de Micromed System S.A.
8. Estos dispositivos pueden quebrarse cuando están sujetos a aumento de carga asociada a la consolidación demorada o no consolidación.
9. Se deben evitar marcas en el implante así como también revertir doblez o doblar el dispositivo en zonas donde haya orificios.
10. Se recomienda no quitar el implante una vez finalizada su vida útil: el tejido blando se oseointegra al hueso que rodea al implante y la eliminación del implante puede significar dañar el injerto y el riesgo de la aparición de nuevas patologías.
NOTA:
MICROMED SYSTEM S.A. puede garantizar la esterilidad del producto hasta el momento de su utilización siempre que no haya un uso y una práctica indebida.
Empaque e Identificación
Los productos estériles se presentan en doble pouch, siendo el pouch primario estéril, contenidos en un sobre de papel aluminio termosellado, para preservar la integridad.
Los productos no estériles se presentan en un simple pouch.
Los implantes Micromed System S.A. solo deben ser aceptados si el embalaje y rótulo se encuentran intactos.
Comuníquese con nuestro servicio al cliente si el embalaje del producto llega abierto o alterado.
Esterilización
En el caso que el producto se suministre estéril, es esterilizado por radiación gamma o por óxido de etileno, tal como se indica en el rótulo externo.
No utilice ningún componente que se encuentre en un envase abierto o dañado. No utilice los implantes después de la fecha de vencimiento.
Cuando el producto se presenta como “No estéril” se recomienda esterilizar el producto por Óxido de Etileno con los siguientes parámetros:
Preacondicionamiento
Temperatura: Máximo: 40 °C Mínimo: 35 °C
Humedad: Máximo: 70 %HR Mínimo: 30 %HR
Esterilización
1. Tiempo de Exposición: 4 Hs.
2. Temperatura de la Cámara: 50 +/- 2C°.
3. Humedad relativa de la Cámara: 40 %HR +/- 5 %HR.
4. Concentración de ETO: 450 +/- 10 mg/L.
5. Vacío Inicial: 500 mm Hg +/- 10 mmHg.
Aireación
Temperatura: 30 °C +/- 5 °C
Humedad: 20 – 40 %HR
Horas de Permanencia: 96 Horas
El INSTRUMENTAL se provee “NO ESTERIL”, debiendo ser esterilizado antes de su uso.
Antes de iniciar el proceso de esterilización asegurarse que el instrumental esté rigurosamente limpio.
Limpieza:
Todo proceso de limpieza se debe realizar utilizando el equipamiento de protección individual vigente en el sector.
Para llevar a cabo el lavado de instrumental, debe tener:
- Batea / Máquina ultrasónica;
- Cepillo de cerda blanda;
- paños libre de pelusa;
- Guantes quirúrgicos;
- Guantes anti-punzante;
- Probeta de vidrio graduada;
- Detergente enzimático;
- Alcohol etílico 70%
- Peróxido de hidrógeno
El procedimiento de lavado se puede realizar de forma automática, en una máquina de ultrasonido, o de forma manual. En ambos casos, el tiempo de ciclo de lavado es de 30 minutos a una temperatura de 30 ± 1 °C. El agua no debe exceder de 40-45 °C, ya que temperaturas más altas pueden causar el endurecimiento de los líquidos provenientes del procedimiento quirúrgico, lo que dificulta la limpieza del instrumental.
Llene la batea de lavado con agua filtrada; por cada litro de agua filtrada se debe colocar 5 ml de detergente enzimático.
Es necesario desmontar completamente cada instrumento de forma manual, para permitir la limpieza de lugares de difícil acceso, y colocar el instrumento comprobando que cada pieza este en contacto con la solución detergente; colocar la batea en la máquina ultrasónica y verificar que los parámetros de la máquina indiquen 30 minutos y 30°C.
En caso de lavado manual, después de 5 minutos de inmersión, cepillar vigorosamente el instrumental en la solución, con el cepillo de cerdas blandas, para eliminar por completo la suciedad.
El instrumental que no puede ser sumergido debe limpiarse con peróxido de hidrógeno y alcohol al 70%.
Enjuagar por arrastre el instrumental con agua filtrada, moviéndolo en diferentes posiciones con el fin de asegurar el lavado completo.
Limpiar la caja de instrumental con un paño humedecido con agua oxigenada y luego con un paño libre de pelusa humedecido con alcohol al 70%;
Secado:
La etapa de secado se lleva a cabo inmediatamente después del lavado. Se debe tener:
- Batea
- El aire comprimido;
- Paños libre de pelusa;
- Guantes quirúrgicos;
- Guantes anti-punzante;
- Alcohol etílico 70%
Se procederá de la siguiente manera:
Pasar un paño libre de pelusa humedecido con alcohol al 70% a lo largo de la mesa de trabajo y sumergir el instrumental en una batea con alcohol al 70% durante 3 minutos, luego retirar el instrumental y secar con paños absorbentes libre de pelusa; finalmente se debe secar con aire comprimido.
Poner el instrumental en la caja, la cual previamente se debe secar con un paño libre de pelusa.
En caso de instrumental desmontable es necesario secar pieza por pieza eliminando la posibilidad de humedad oculta entre éstas, debe estar completamente seco, ya que el agua en contacto con el acero inoxidable durante demasiado tiempo puede tornar susceptible el material al comienzo de un proceso de corrosión.
Esterilización
El instrumental debe ser esterilizado antes de su uso. Se recomienda la esterilización en autoclave de vapor saturado a 121º C por un tiempo de 15/20 minutos.
Es muy importante el control de los parámetros específicos y configuración de equipos en cada institución de salud, así como las medidas de mantenimiento preventivas adecuadas. El operador debe controlar todos los ciclos de esterilización y evaluar la eficacia del proceso de esterilización.
Para obtener información e instrucciones específicas a tener en cuenta por centros donde se realice limpieza y/o esterilización de este instrumental, se recomienda consultar las siguientes Normas Internacionales:
- ISO 17665 - 1 - Esterilización de productos para el cuidado de la salud – Calor húmedo - Parte 1: Requisitos para el desarrollo, validación y control de rutina de un proceso de esterilización de productos sanitarios.
- ANSI / AAMI ST46 - Buenas prácticas hospitalarias: esterilización por vapor y garantías de esterilidad.
- ANSI / AAMI ST35 - Manipulación segura y descontaminación biológica de productos médicos reutilizables en centros sanitarios y en ambientes no clínicos.
Nota: todo el instrumental debe limpiarse al término del procedimiento quirúrgico evitando de esta forma el endurecimiento de los líquidos originados del trabajo quirúrgico. Todo proceso de limpieza debe realizarse con orden y cuidado evitando marcas, sacudidas que puedan comprometer el instrumental.
IMPORTANTE! Las cajas de instrumentos no proporcionan una barrera estéril y deben utilizarse junto con un envoltorio estéril para conservar la esterilización.
Las cajas de instrumentos sin envoltorio NO conservan la esterilidad.
Micromed System S.A. desconoce otros métodos de utilización, como también los procedimientos de higiene sanitaria y la población microbiana de cada institución. Por lo expuesto la empresa no puede garantizar la condición de esterilidad del producto en el momento de su utilización, aun cuando se sigan estas instrucciones.
Condiciones de almacenamiento
Almacenar en su envase original, en lugar limpio, a temperatura ambiente (≤ 30 °C) y humedad relativa ambiente.
Técnica Quirúrgica
Cranial Botton
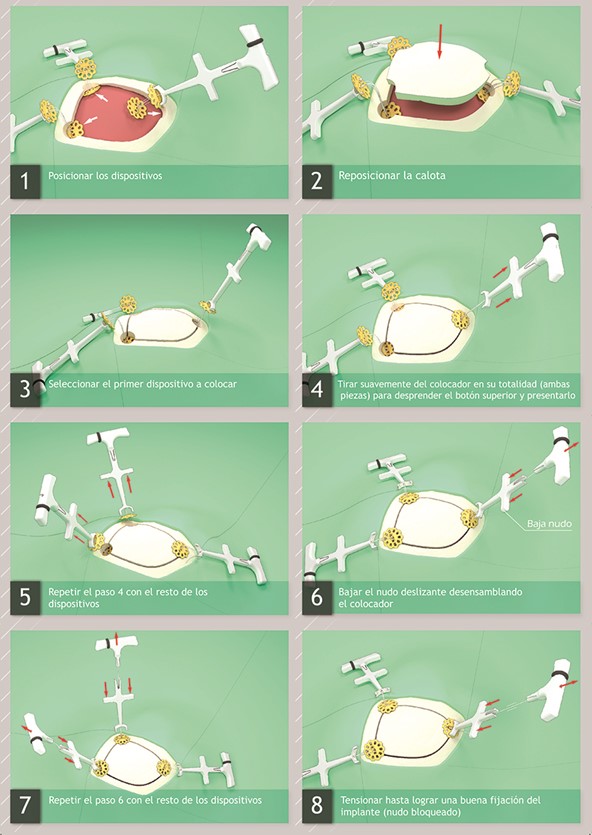
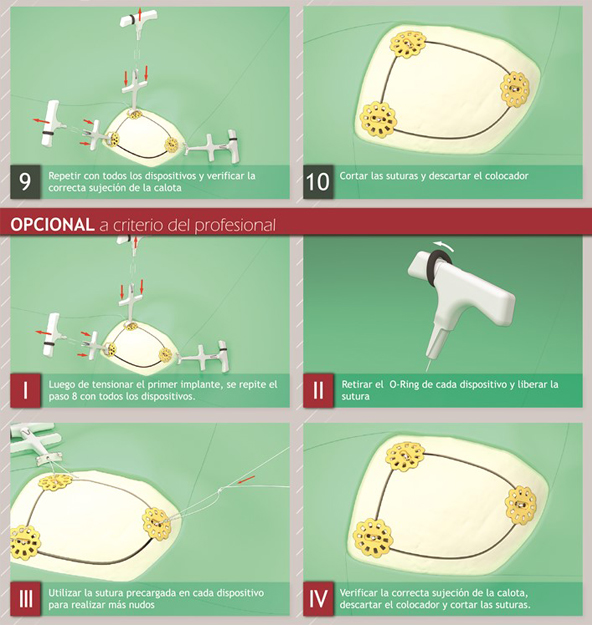
Autorizado por la ANMAT PM-1451-17.
Información Complementaria En Rotulo Del Producto.
PRODUCTO MÉDICO DE UN SOLO USO.
VENTA EXCLUSIVA A PROFESIONALES E INSTITUCIONES SANITARIAS.
USO PROFESIONAL EXCLUSIVO.
Productos fabricados por:
MICROMED SYSTEM S.A.
Araoz 149 - CABA
Tel/fax: + 54 11 4856 2481/2697
www.micromedsystem.com
ET560 V02
